徕卡显微镜在核孔复合组织时提出的新见解
核孔复合物 (NPC)在核膜一个大的蛋白质复合物,表示其栅极连接到所述真核基因构成。 这种复杂的由几百形成为注定要进入或离开核化合物的选择性栅极蛋白质。
正因为如此出色的功能NPC的结构是极大的兴趣。 到目前为止,全国人大结构分析已主要限于结晶研究或电子显微镜(EM)。 单组分的几种结构已经被破译通过晶体学。 然而,复杂的内各个蛋白质的组织仍然难以捉摸。 一个间隙现已关闭通过使用超分辨率显微镜。
扬Ellenberg和他的科学家团队在EMBL海德堡已经获得了新的见解的NPC结构的徕卡显微镜基态损耗(GSD)的帮助。
安娜·辛波丝卡Zui近公布的这项研究的科学文章中的结果“核孔支架结构由超分辨率显微镜和粒子平均分析”和她的成就的意见和基态损耗显微镜的蛋白复合物的分析在随后的采访中的潜力。
什么是GSDIM方法的研究优势?
在我们的研究中,我们试图了解大型多蛋白复合物,如核孔复合物(NPC),都建立。 因为它们的尺寸和复杂性,例如分子机器都超出了单个方法的范围和长期以来一直用于结构生物学的一个挑战。 原子分辨率的方法,例如X射线晶体学或核磁共振需要纯化的样品,并且不适合于非常大的集。 虽然,电子显微镜可以观察大复合体在其天然环境中的细胞,它往往是很困难的分配的电子密度,以个别蛋白质。 在荧光显微镜中的蛋白质的身份是已知的,超分辨率(SR)现在让我们来可视化低于衍射极限的细节。 当SR被结合的颗粒平均,蛋白'位置可以被映射到一个亚纳米精度,一个尺度,使得适用于大型复合结构的研究光镜。 因此SR显微镜可以连接不同类型的数据,Zui终帮助生成的多蛋白组件伪原子模型。 此外,特别是GSDIM等本地化SR方法的一大优势是,他们使用比较简单,并定期让蛋白,是10-20纳米相隔的分辨率。 这对我们来说很重要,因为我们能够获得大的数据集,并期待在许多不同的标记在一个相对有效的方式。
什么是新的洞察它给了你关于核孔复合体的结构? 你去过哪些细节能够看到第一次?
Nucleoporins是建立核孔(见图1)的蛋白质。 首次,SR显微镜使得有可能解决的几个这些蛋白质的组织中的环周围的人大。 平均数千这些环允许我们测量不同nucleoporins的位置相对于所述孔的与亚纳米精度的中心.然后我们可以系统地进行比较,构成所谓Nup107-160 subcomplex,这是人大Zui大积木和孔的结构骨架的主要组成部分nucleoporins的径向位置。
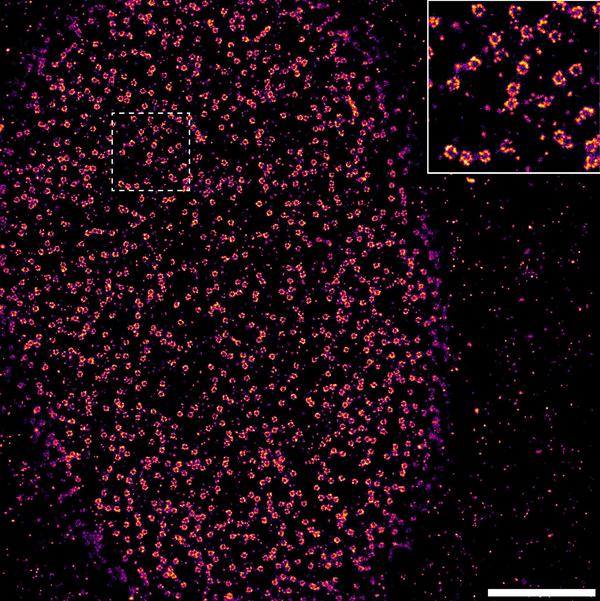
图1:一个U2OS细胞标记抗核孔蛋白Nup133的抗体和缀合的Alexa Fluor沿着传输轴线观察647.个别的NPC的二次抗体的核的底面是作为环状结构可见。 比例尺:3微米。
如何将我们的核孔复合物的认识已经被现在修改?
在我们Zui近的研究中,我们提供的位置限制为Nup107-160 subcomplex的成员和在此基础上的数据,我们能够解决一个长期存在的争论在该领域:本subcomplex的取向的问题相对于所述传输轴。 这是理解如何NPC的结构支架的组织又迈进了一步。 我们希望,在未来,我们将能够映射毛孔所有蛋白质,并提供这一重要运输机的全面的结构模型。
请描述您刚刚开发用于组合数千超分辨率显微镜图像,达到低于1纳米精密的方法。
虽然SR显微镜让我们想象周围的NPC中心nucleoporins的组织,这些图像的原始分辨率将不足以直接看到相同的subcomplex个别蛋白质之间的微小差异。 因此,我们开发了一种分析方法,其中,染色用特定的标记个别的NPC的许多图像在空间中仔细对齐的孔的中心,或者在标记的第二信道的参考蛋白质的位置,然后被相加,以产生的平均图像(见图2)。 由于我们使用几千相同的结构的图像,该注册过程是非常精确的。 我们随后能够通过用适当的数学模型拟合平均信号,以确定的荧光标记物的位置。 重要的是,我们发现,这个平均化过程的精度在很大程度上取决于对原始数据的质量在一定程度上。 为了使我们的测量不同的蛋白和实验之间绝对的可比性和消除低质量的染色潜在的文物,我们实现了一个自动分析的管道控制参数,如定位精度和密度。 关于生产的统计学显著数据,我们可以在从GSDIM方法的可靠性和坚固性和有效的漂移补偿(SUMO)阶段加成益处。

图2:平均过程示例结果。 (A)的NPC的图像标记对Nup96抗体(高斯滤波)。 (B)NPC的平均图像用针对Nup96抗体通过比对和8000图像各个毛孔的总结产生。 (三)各地人大的中心上Nup96荧光标记,从平均图像的轮廓确定的平均位置。 比例尺:0.1微米。
总而言之,我们的方法是通用的,并允许确定该荧光标记的位置相对于中心对称结构的或具有亚纳米精度和精度的参照蛋白质。 应用这种方法的核孔的几个不同的蛋白质,我们可以相对于所述结构的中心分配它们的相对位置。 此信息使我们能够确定在NPC支架单个subcomplex的方向(见图3)。
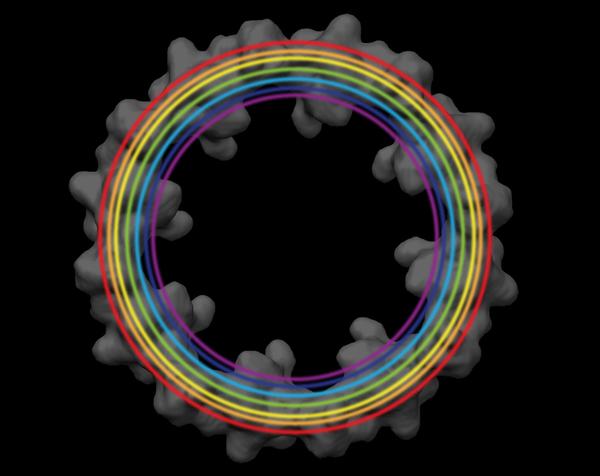
图3:应用的平均化过程在Nup107-160 subcomplex(由不同颜色描绘)的几个表位,它们的相对位置可被确定。 染色通过使用GFP融合蛋白的纳米抗体的标签来实现。 位置信息是与覆盖全国的细胞质环的EM结构。 电子密度图礼貌O. Medalia教授
什么是要克服用于制备超分辨率的样品的一般障碍? 你使用这个研究,标记?
当工作在这个项目中,我们意识到,获得Zui佳的荧光标记是在一个SR实验中Zui关键的步骤和超分辨率方法一般需要更高质量的样本比传统的显微镜。 尽管几个方面的样品制备的,如低背景和良好的结构保存,是重要的,这两个Zui重要的限制因素在我们的情况下是标记试剂的大小,和可实现的标签密度。 Zui初我们使用间接免疫荧光用抗核孔蛋白的抗体,这使得内源性蛋白在细胞中的特异性标记。 然而,使用的抗体的一个主要问题是它们的大小 - 它们可以通过Zui多为15nm可能抵消从目标表位的荧光团。 此外,我们的平均方法需要具有高密度的标签样本。 这仅是可实现具有非常高的亲和力的抗体和我们只能够获得这样的试剂,用于我们感兴趣的,我们通过表达nucleoporins作为GFP融合蛋白和染色的样品的荧光小解决这两个问题的nucleoporins的一个子集标记的抗GFP纳米抗体,这是只有十分之一的常规IgG的大小,从而减少了潜在的一半以上的偏移。 重要的是,这个标签是由基因编码它使我们能够在一个简单的和可比的方式标注几个nucleoporins。 为了达到Zui大的标记密度,我们通过RNA干扰耗尽内源性未标记的蛋白质。(奥林巴斯显微镜)
你看到了使用新的GSD 3D技术在你的研究领域是什么可能性?
像所有的大蛋白质复合物,人大是一个三维结构,并为了了解它是如何建成,超分子组装体的所有部分的一个高分辨率三维视图将是必要的。 尽管我们Zui近的研究提供了新的见解全国人大支架的组织,我们只能够确定nucleoporins的位置在一个方向 - 沿孔的半径。 在3D执行这样的测量将更加翔实。
此外,我们相信,超高分辨率显微镜将成为不只是核孔结构的研究,还包括其他大蛋白组件的有价值的工具。然而,在人大的情况下,我们是由以下事实,即细胞核几百孔的底部是在相同的方向可见帮助 - 这简化我们的分析。 这种择优取向没有找到许多其他有趣的多蛋白组件的,和超分辨率这种复合物的结构研究将只可能与3D成像。